|
上海沙格企業管理咨詢有限公司

| 聯系人:陳小姐
女士 (銷售部) |
| 電 話:021-68597208 |
手 機:15001902415  |
 |
|
 |
|
| 巴西ANVISA認證流程詳解 |
隨著國內制造商的海外市場不斷拓展,巴西醫療器械市場準入的需求也不斷上升。為適應廣大客戶的需求,開啟了巴西市場準入服務。巴西市場對于醫療器械的準入有哪些要求,我們一起來看看吧。
01巴西醫療器械法規介紹
巴西醫療器械適用法規主要包括:適用于一般器械的Resolution RDC 751/2022和Resolution RDC 40/2015;適用于植入器械的Resolution RDC 185/2001;以及適用于體外診斷器械IVD的Resolution RDC 830/2023(于2024年6月1日正式生效)。
巴西法規對于醫療器械按照風險高低分為四類,其中一類風險*低,四類風險*高。分類規則,參考Resolution-RDC No.751, Attachment 1,和MDR分類規則基本一致。
基于產品風險等級的不同,巴西當局規定了不同的合規路徑。其中I類和II類按照Cadastro路徑,而III類和IV類按照Registro 路徑執行。
但是不論是什么風險等級,境外制造商都應指定一名巴西授權代表作為持證人(BRH)來申請巴西當局ANVISA的相關證書。
02 巴西市場準入合規流程
1. 基本流程
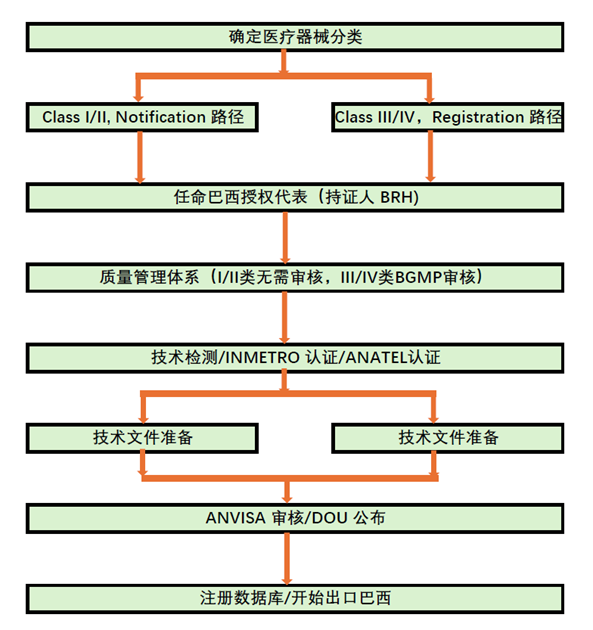
對于中國醫療器械產品希望出口巴西市場,基本流程如下:
確定醫療器械分類,并確定合規路徑;
對于I/II類按照Notification備案路徑,III/IV類按照Registration注冊路徑;
指定巴西授權代表,也是ANVISA注冊證書的持證人;
建立質量管理體系以滿足巴西GMP的要求,其中III/IV類需要通過ANVISA的審查;
完成產品檢測,必要時完成INMETRO認證和ANATEL認證;
提交技術文件;
ANVISA評審審批;
產品出口巴西市場。
我們提供的服務項目
針對巴西醫療器械市場準入,我們可以提供的服務包括:
巴西授權代表;
巴西注冊文件編寫;
巴西注冊提交以及和ANVISA的聯絡;
INMETRO認證和ANATEL認證的聯絡安排;
BGMP審核輔導/MDSAP輔導/陪同審核;
協助企業獲得進口許可證。 |
|
|